Preview
Sistem ekskretoris terdiri dari dua sistem organ yang bekerja bersama: tubulus Malphigi dan hindgut. Tubulus Malphigi biasanya muncul di persimpangan pertengahan dan hindgut. Proton disekresikan ke lumen tubulus Malphigi oleh pompa proton membran memberikan kekuatan pendorong untuk pembentukan urin. Ion potassium (K +) masuk sel tubul Malphigi dari sisi hemolymph melalui saluran potassium, dan kemudian mereka disekresikan ke dalam lumen tubula oleh mekanisme membran antiporter yang bertukar ion hidrogen (H +) untuk K +. Cairan dari hemolymph mengikuti gradien osmotik yang diciptakan oleh gerakan K + melintasi sel tubulus dan membawa zat terlarut ke dalam lumen tubulus. Tubulus mentransfer urin yang terakumulasi ke hindgut, di mana reabsorpsi selektif oleh ileum dan rektum menahan zat-zat yang diperlukan di dalam tubuh, sementara memungkinkan produk-produk limbah dan ekses zat berguna untuk dibuang dengan limbah feses. Spesialisasi dalam sel epitel hindgut memfasilitasi proses reabsorpsi. Sistem ekskresi memainkan peran utama dalam homeostasis hemolymph, sel, dan jaringan dengan membantu mengontrol kadar elektrolit, air, setara asam-basa, dan metabolit nitrogen. Homeostasis ditantang oleh kebiasaan makanan, habitat, dan keadaan metabolik serangga. Beberapa produk ekskretoris dapat disimpan di dalam tubuh atau kutikula di mana mereka dapat menawarkan perlindungan dari predasi dan parasitisme. Serangga memiliki rasio volume permukaan yang tinggi dan menantang sistem ekskretoris mereka untuk menghemat air daripada membuangnya. Serangga lainnya mengambil makanan cair besar, seperti darah vertebrata, getah floem tanaman, atau getah xilem, masing-masing makanan terdiri dari lebih banyak air daripada yang dibutuhkan, sehingga mereka cepat mengeluarkan air dan memusatkan nutrisi. Beberapa serangga (terutama Lepidoptera dan Coleoptera) memiliki sistem cryptonephridial tubulus Malphigi di mana ujung distal tubulus dipegang erat ke permukaan rektum dalam banyak loop dan lipatan. Loop lebih luas pada serangga yang hidup di lingkungan yang sangat kering, tampaknya membantu dalam reabsorpsi air.
17.1 Pendahuluan
Ekskresi dapat didefinisikan secara luas sebagai proses yang menghilangkan interaksi zat berbahaya dengan sel dan jaringan. Bahkan zat yang bermanfaat, seperti glukosa, asam amino, dan ion tertentu, bisa berbahaya jika ada dalam jumlah berlebih. Metabolisme nitrogen, ion, air, dan bahan kimia tertelan adalah zat yang mungkin perlu dikeluarkan oleh serangga. Allelochemicals dari jaringan tanaman yang dimakan dapat dikeluarkan dari tubuh atau disimpan di beberapa lokasi inert di dalam tubuh. Misalnya, Manduca sexta, cacing tembakau, secara efisien mengeluarkan nikotin yang dicerna dengan makanan inangnya, daun tanaman tembakau (Baldwin, 1991), sementara Danaus plexippus, kupu-kupu raja, menyimpan cardenolides dari milkweed di kutikula larva dan dewasa. , di mana mereka bertindak sebagai perlindungan kimia dari predator (Brower, 1969).
Maddrell (1971) mendefinisikan penyimpanan ekskresi untuk memasukkan bahan dengan potensi penggunaan masa depan, seperti glikogen sebagai bentuk penyimpanan glukosa atau asam amino yang disimpan sebagai protein. Dia memandang ekskresi deposit sebagai bahan limbah yang tidak digunakan lagi yang perlu dihapus dari interaksi berbahaya dengan jaringan. Perbedaan antara ekskresi penyimpanan dan penyimpanan, bagaimanapun, sangat halus dan tidak disetujui oleh semua orang.
Pada serangga, tubulus Malpighian dan fungsi hindgut bersama-sama sebagai organ ekskretoris. Tubulus Malpighian mengumpulkan filtrat dari hemolymph, dan melewatkan air kencing primer ini ke hindgut. Komponen tambahan disekresikan ke dalam ekskreta oleh hindgut, dan beberapa zat diserap kembali ke dalam hemolymph (Gambar 17.1). Istilah "ekskreta" menjelaskan materi yang sebenarnya dihilangkan dari anus oleh serangga karena merupakan campuran bahan tercerna yang melewati usus, zat-zat yang ditindaklanjuti dan mungkin dimodifikasi oleh aksi bakteri di usus, dan materi urin dari tubulus Malphigi. Ekskresi serangga telah sering ditinjau dan ekstensif. Pembentukan urin tubulus primer ditinjau oleh Maddrell (1977, 1980), Phillips (1981), Bradley (1985), Spring (1990), Nicolson (1993), dan Pannabecker (1995). Reabsorpsi selektif di hindgut telah ditinjau oleh Phillips et al. (1986). Bursell (1967) dan Cochran (1975, 1985a). Cochran (1985b) meringkas fungsi keseluruhan sistem ekskresi pada serangga.
17.2 Tubulus Malpighian
Tubulus Malpighian, yang pertama dari dua sistem yang terlibat dalam ekskresi, panjang, struktur tubular, biasanya timbul di persimpangan pertengahan dan belakang dan mengakhiri secara membuta di hemocoel. Beberapa variasi dalam morfologi kotor sistem tubulus Malphigi ditunjukkan pada Gambar 17.2. Tubulus bervariasi dalam jumlah dari 2 hingga lebih dari 100 dalam berbagai spesies serangga. Collembola, Aphidae, dan beberapa Thysanura tidak memiliki tubulus Malpighian sama sekali, dan sel dan kelenjar lain mengambil alih fungsi ekskresi. Dalam beberapa anggota Lepidoptera dan Coleoptera, ujung distal tubulus tertanam di dinding rektum (lihat bagian selanjutnya). Pengaturan ini, disebut tubulus cryptosolenic atau cryptonephridial, tampaknya menjadi modifikasi yang membantu konservasi air. Koneksi trakea ke tubulus Malpighian sangat banyak, dan merupakan indikasi kebutuhan metabolisme yang tinggi untuk oksigen. Sebuah spiral kecil otot (Gambar 17.3) sering berjalan sepanjang permukaan tubulus, mempromosikan gerakan melingkar yang membantu aliran proksimal cairan dan meningkatkan hemolymph dalam kontak dengan tubulus. Beberapa tipe struktural tubulus dapat terjadi pada serangga yang sama (Gambar 17.4).Tubulus Malpighian tidak hanya penting dalam ekskresi. Mereka memiliki banyak fungsi pada serangga, termasuk detoksifikasi (Leader dan O'Donnell, 2005), fungsi metabolisme, peran dalam kekebalan, dan, sekarang, bahwa genom Drosophila melanogaster, Anopheles gambiae, dan Apis mellifera diketahui, mereka dapat melayani. untuk studi organotipik gen manusia (ditinjau dan dibahas oleh Dow dan Davies, 2006).
17.3 Ultrastruktur dari Sel Tubulus Malpighian
Satu lapisan sel epitel (biasanya terdiri dari dua hingga lima sel) mengelilingi lumen tubulus. Beberapa jenis sel yang berbeda telah diidentifikasi, tetapi fungsi spesifik mereka belum dijelaskan dalam banyak kasus. Beberapa, tetapi tidak semua, sel tubulus memiliki batas kuas mikrovili di permukaan apikal, dan ini telah disebut Tipe 1 atau sel tubulus utama (Gambar 17.5). Sel di setengah bagian distal tubulus di Rhodnius prolixus memiliki perbatasan sikat di permukaan apikal sel dan terlibat dalam pembentukan urin primer. Sel di bagian proksimal tubulus memiliki permukaan apikal yang relatif halus di mana reabsorpsi terjadi, mungkin oleh mekanisme yang membutuhkan energi (Wigglesworth, 1931).Sel tubulus adalah sel tipis seperti selembar yang membungkus lumen tubulus. Komponen air dan hemolimfa yang masuk pada sisi basal sel hanya memiliki jarak pendek untuk melintasi mencapai permukaan apikal di mana mereka mungkin disekresikan, atau difus, ke dalam lumen tubulus. Sel tubulus Malpighian ditandai dengan infus yang luas dari membran basal (membran di sisi hemolymph), menciptakan banyak saluran memutar yang mencapai 5 hingga 10 μm atau lebih ke dalam sel (O'Donnell et al., 1985) (Gambar 17.6) . Ion-ion potassium dalam hemolimfa memasuki sel-sel tubul Malpighian melalui gerbang ion potassium pada saluran-saluran yang masuk ke dalam membran basal (Nicolson dan Isaacson, 1990), dan air dan zat-zat terlarut dalam media berair hemolymph mengikuti gradien osmotik (Gambar 17.7). Permukaan membran luas yang disajikan oleh permukaan basal dan apikal sel tubulus Malphigi dan mitokondria besar merupakan indikasi spesialisasi untuk transpor aktif serta difusi pasif.
17.4 Pembentukan Urin Primer di Tubulus Malpighian
Urin primer yang terbentuk di lumen tubulus Malphigi adalah filtrat dari hemolymph (Ramsay 1953, 1955a, 1955b, 1956, 1958), dan mengandung sebagian besar ion dan molekul kecil (gula, asam amino, ion, juga sebagai komponen lain) yang terjadi di hemolymph. Urin: rasio konsentrasi hemolimfa untuk banyak zat yang disaring mendekati kesatuan, menunjukkan gerakan pasif melintasi membran sel tubulus, tetapi beberapa komponen secara aktif disekresi dan urin mereka: rasio hemolimfa selalu lebih besar dari satu.
17,5 Proton Pump adalah mekanisme Penggerak untuk Pembentukan Urine
Pembentukan urin di tubulus Malphigi bergantung pada pompa proton, yang tidak ditemukan hanya di tubulus Malphigi, tetapi juga di midgut dan rektum (lihat Bab 2 untuk rincian lebih lanjut tentang pompa proton). Pompa terletak di membran apikal (sisi yang menghadap lumen) sel tubulus Malphigi dan aktif mengeluarkan proton, H +, ke dalam lumen tubula terhadap gradien elektrokimia (Wieczorek et al., 2000; Hopkin et al., 2001; Weng et al., 2003). Pompa terdiri dari kompleks protein V1 dalam sitoplasma sel-sel utama (sel-sel utama di tubulus Malphigi, tetapi kadang-kadang sel-sel lain terjadi, seperti sel stellata) dari tubulus Malphigi, dan saluran ion yang dibentuk oleh kompleks Vo transmembran yang tertanam. di bilayer lipid dari membran apikal. Pompa menyebabkan lumen tubula menjadi positif (sebanyak +30 mV atau lebih pada beberapa serangga) ke hemolymph, dan menciptakan gradien sangat bervariasi dalam pH melintasi membran apikal sel utama. Gradien proton menyediakan energi untuk mekanisme antiporter itu bertukar K + untuk H + melintasi membran apikal (Forgac, 1989; Weltens et al., 1992; Maddrell dan O'Donnell, 1992; Zhang et al., 1993; Wieczorek et al., 2000). Hasil bersihnya adalah bahwa K + disekresikan ke dalam lumen tubulus dan dipusatkan pada gradien elektrokimia. Tiga gen penyandian saluran penyearah ke dalam di Drosophila, ir, irk2, dan irk3, telah diidentifikasi dalam sel-sel utama (Evans et al., 2005). Pada beberapa serangga yang mengonsumsi makanan darah kaya Na + (misalnya, nyamuk dewasa, R. prolixus, dan lalat dewasa tsetse), Na + secara aktif diangkut oleh mekanisme pompa. Pompa ini mungkin diatur oleh disosiasi / reasosiasi (Kane dan Parra, 2000) dan kemungkinan berada di bawah regulasi genetik pada tingkat transkripsi dan posttranscriptional (Wieczorek et al., 1999).Kation, seperti K + dan / atau Na + dan mungkin anion, harus memasuki sel tubulus Malphigi (di permukaan basolateral) dari hemolymph agar sekresi ke lumen di wajah apikal sel untuk melanjutkan. Masuknya ion pada permukaan membran basolateral, bagaimanapun, tidak dipahami dengan baik. Sekresi kation (H +, Na +, dan K +) di seluruh membran apikal tampaknya digabungkan secara elektrik dengan Cl-transport (Beyenbach, 1995; Dijkstra et al., 1995) dalam membran basolateral sel tubulus, menyediakan keseimbangan dan stabil kondisi keadaan antara masuknya kation dari hemolymph melintasi membran basolateral dan sekresi melintasi membran apikal (Beyenbach et al., 2000b). Klorida dapat diangkut oleh jalur paraseluler (yaitu, di antara sel-sel yang berdekatan) pada beberapa serangga, seperti Aedes aegypti (Beyenbach et al., 2000a, 2000b) atau dengan jalur transeluler pada orang lain (O'Donnell et al., 1998, dalam tubulus Drosophila melanogaster). Ada bukti bahwa rute untuk Cl-transportasi dapat bervariasi dalam organisme yang sama dalam menanggapi kondisi fisiologis variabel (Dijkstra et al., 1995) dan / atau stimulasi hormonal (Yu dan Beyenbach, 2001). Berdasarkan pengukuran potensi transepitel di sel tubulus dan lumen Malphigi, Ianowski dan O'Donnell (2001) menyarankan stoikiometri Na +: K +: 2Clotransport melintasi membran basolateral sel tubulus di R. prolixus.
Meskipun sekresi K + ke lumen tubulus telah diketahui selama setengah abad (Ramsay, 1953, 1955a, 1955b), penjelasan seluler / molekuler tidak diketahui sampai penemuan pompa proton. Pembentukan volume urin sangat tergantung pada konsentrasi K + dalam mandi hemolymph atau saline, tetapi pembentukan cairan berhenti bahkan ketika konsentrasi K + dalam garam mandi tinggi jika pompa H + dihambat (Bertram et al., 1991; Weltens et al. , 1992). Molekul, seperti gula, asam amino, dan beberapa alelokimia di hemolymph, mengikuti gradien osmotik yang diciptakan oleh pengangkutan K + dan ion-ion lain. Selain mensekresi K +, sel tubulus Malphigi pada beberapa serangga juga mengeluarkan Na +, beberapa ion lain, dan molekul organik. Satu molekul organik, proline asam amino, secara aktif disekresikan ke dalam urin oleh tubulus belalang gurun, Schistocerca gregaria, dan, setelah melewati ke hindgut, ia digunakan sebagai sumber energi untuk produksi adenosin trifosfat (ATP) ke ion bahan bakar. pompa di epitelium hindgut (Phillips et al., 1994).
Proses yang didorong oleh pompa proton telah disebut proses gradien berdiri (Berridge dan Oschman, 1969). Meskipun mungkin menyebabkan sebagian besar urin terbentuk, mungkin ada proses tambahan dimana zat memasuki lumen tubulus. Wessing dan Eichelberg (1975) menyarankan bahwa mungkin ada sejumlah mekanisme yang beroperasi di berbagai serangga untuk menjelaskan beberapa komponen dalam urin, dan mereka menyajikan bukti mikrograf elektron, yang mereka tafsirkan sebagai indikasi lebih dari satu proses yang beroperasi dalam sel-sel tubulus dari Drosophila melanogaster (Wessing dan Eichelberg, 1978). Proses tambahan mungkin termasuk pengangkutan zat tertutup dalam vesikula (Riegel, 1966; Linton dan O'Donnell, 2000), pergerakan bebas zat melalui sitoplasma sel, dan pengalihan zat antara sel-sel yang berdekatan oleh gerakan melalui ruang antar sel. Tak satu pun dari ini tampaknya saling terpisah dari yang lain, dan beberapa mekanisme mungkin beroperasi pada serangga yang sama.
Tingkat pembentukan urin dan sekresi ion dikontrol oleh hormon peptida diuretik dan senyawa nonpeptida tertentu, seperti 5-hydroxytryptamine (5-HT atau serotonin) (ditinjau oleh O'Donnell dan Spring, 2000). Ketika dirangsang secara maksimal, tubulus Malphigi dapat mengeluarkan volume cairan yang sama dengan volume sel mereka setiap 10 detik, tingkat rekor sekresi dalam biologi (Maddrell, 1991; Dow dan Davies, 2003; Evans et al., 2005). Senyawa peptida jatuh ke dalam dua kelas utama, yang mirip dengan faktor pembebasan corticotropin vertebrata, yang disebut peptida terkait CFC, dan kinin yang lebih kecil. Peptida tipe CFC memiliki ukuran mulai dari 30 hingga 46 asam amino, sedangkan kininnya lebih kecil dan terdiri dari 6 hingga 15 asam amino. Meskipun kedua jenis merangsang pembentukan urin, mereka bertindak melalui mekanisme yang berbeda. Peptida CFC (dan 5-HT) menstimulasi siklase adenilat dan meningkatkan tingkat cAMP (siklik adenosin monofosfat), sedangkan kinin yang telah dipelajari ke titik ini mengaktifkan jalur Ca2 + -signaling. Tingkat sekresi tubulus Malphigi biasanya
dikendalikan oleh interaksi beberapa senyawa ini. Faktor-faktor diuretik dapat menghambat sinergisme (yaitu, aktivitas yang lebih besar dalam kombinasi daripada efek aditif dari masing-masing saja) atau alternatifnya, efek dari beberapa senyawa mungkin hanya aditif, tetapi jalur kation dan anion dikendalikan secara terpisah oleh utusan kedua yang berbeda. Dalam satu kasus, interaksi penghambatan diketahui. Dalam hemipatter hemostatian Rhodikel prolixus, dua faktor, 5-HT dan hormon diuretik (DH), bertindak secara sinergis untuk merangsang pembentukan urin di tubulus, tetapi peptida ketiga, cardioacceleratory peptida 2b (CAP2b,), bertindak sebagai hormon antidiuretik ketika bagian dari campuran. Efeknya dimediasi melalui stimulasi cGMP (siklik guanosin monofosfat) yang kemudian menghambat aksi 5-HT. Tindakan sinergis dari hormon-hormon ini mungkin menguntungkan serangga dengan mengurangi jumlah hormon yang dilepaskan dan memastikan bahwa semua tubulus merespon dengan cepat. Pada serangga yang memakan makanan besar, seperti nyamuk, beberapa hemipterans, dan pengumpan floem dan xilem, aksi sinergis hormon dapat mengkompensasi pengenceran hemolymph karena air dari makanan besar diserap ke dalam hemolymph.
Urin primer yang terbentuk oleh tubulus Malphigi adalah isosmotik atau kadang-kadang sedikit
hyposmotic ke hemolymph. Tubulus Malpighian tidak mampu menghasilkan urin primer yang sangat hyperosmotic ke hemolymph. Tubulus proksimal dapat memodifikasi urin dengan reabsorpsi beberapa zat (misalnya, dalam R. prolixus), tetapi banyak serangga memindahkan cairan tubulus ke hindgut dengan sedikit atau tidak ada perubahan dalam komposisi atau volume kimianya. The hindgut kemudian mulai memusatkan produk limbah dengan menyerap kembali air dan zat yang berguna.
Penggunaan tubulus terisolasi (Gambar 17.8 dan Gambar 17.9), teknik yang awalnya dirancang oleh Ramsay (1954), terus menjadi teknik penelitian penting untuk menjelaskan fisiologi tubulus (Nicolson dan Hanrahan, 1986; Isaacson et al., 1989; Hegarty et al., 1991; Leyssens et al., 1992, 1993). Tubulus terisolasi mengeluarkan tetesan urin yang dapat diukur volumetrically dengan asumsi tetesan memiliki dimensi bola. Tingkat sekresi khas diukur dalam nanoliter per menit (nl / menit) selama beberapa jam ditunjukkan pada Gambar 17.10. Dengan teknik ultrasensitif saat ini, cairan yang cukup dapat dipulihkan untuk analisis mikrochemical (Beyenbach, 1995, dan referensi di dalamnya).
17.6 Reabsorpsi Selektif di Hindgut
17.6.1 Spesialisasi Anatomi Sel Epitelial Hindgut
The hindgut adalah sistem kedua yang melengkapi proses ekskresi dengan secara selektif menyerap kembali beberapa zat ke dalam hemolymph, meninggalkan yang lain di lumen, dan aktif mensekresi beberapa zat ke dalam lumen hindgut. Lapisan rektik rektal memiliki permeabilitas yang lebih besar daripada lapisan kutikula pada sel foregut, dan sel-sel epitel dari hindgut dikhususkan untuk sekresi aktif dan reabsorpsi aktif. Phillips dan Dockrill (1968), yang menyingkirkan dan menguji permeabilitas lapisan kutikula dari hindgut S. gregaria, menemukan bahwa molekul dengan berat molekul 300 hingga 500 melintasi membran secara perlahan, dan molekul memiliki radius lebih besar dari sekitar 0,5 0,6 nm menembus sangat lambat atau tidak semua. Glukosa (0,42 nm radius, berat molekul [MW] 180) menembus dengan mudah, sementara trehalose (0,52 nm radius, MW 342) menembus jauh lebih lambat. Meskipun ini tidak boleh dianggap sebagai norma untuk semua serangga, mungkin sama dengan serangga lainnya.Dalam rektum, kelompok-kelompok kecil sel berbagai disebut sel-sel rektal, sel-sel pad rektal, atau
sel papilla rektum pada serangga yang berbeda. Kelompok sel ini memiliki modifikasi khusus untuk reabsorpsi. Di Diptera, empat sampai enam papila jari-seperti (Gupta dan Berridge, 1966; Hopkins, 1967) melekat pada dinding rektum dan proyek ke lumen rektal (Gambar 17.11). Lapisan chitinous pada permukaan luminal papillae terus menerus dengan lapisan pada dinding bagian dalam rektum. Sel-sel papilla rektal besar, biasanya sel-sel kuboid yang mengelilingi saluran sentral di papila yang membuka ke ruang hemolymph melalui katup (Gambar 17.12). Cairan yang melintasi sel papila rektal dan memasuki saluran pusat dikembalikan ke hemolymph. Trunkus ttrakea kecil dan saraf masuk ke rongga tengah, dan batang trakea bercabang menjadi trakea dan tracheoles yang lebih halus, menunjukkan tingginya permintaan oksigen untuk kinerja kerja metabolisme dan sekretorik. Dalam sel papilla rektal nyamuk, Aedes aegypti, membran sel lateral memanjang menjadi lipatan selaput yang diarahkan ke dalam yang terletak sangat dekat satu sama lain dan memproyeksikan hampir ke permukaan basal dan apikal sel (Hopkins, 1967). Lipatan membran yang rumit ini menciptakan banyak saluran dan ruang yang dibatasi membran di dalam sel di papillae. Nukleus sel besar dan menonjol. Membran sel apikal (menghadap lumen rektum) dari sel papila rektal juga sangat dilipat, dan mitokondria besar biasanya berhubungan erat dengan saluran interselular yang diciptakan oleh pelebaran membran yang luas.
Sel pad rektum sering ditemukan pada banyak serangga, dan biasanya diperbesar, sel kolumnar ke kuboid diatur dalam enam kelompok yang dipisahkan oleh sel skuamosa yang lebih kecil di antara “bantalan” sel-sel yang menyerap. Sel-sel pad rektum pada lipas, P. americana (Phillips, 1981), memiliki membran sel yang sangat terlipat pada permukaan lumen rektal yang menyajikan 10 hingga 20 kali luas permukaan membran halus. Mitokondria terletak di dekat dan di dalam lipatan apikal, dan sering terjadi di tumpukan kompak dalam hubungannya dengan membran lateral yang sangat melipat. Penyebaran membran yang luas menciptakan banyak saluran intraseluler yang mengumpulkan cairan (dengan zat terlarut terlarut) dari rektum dan mengarahkannya ke saluran di antara sel-sel yang berdekatan (saluran interseluler). Saluran interseluler mengarah ke membran basal sel pad di mana air dan zat terlarut berguna masuk kembali ke hemolymph. Membran saluran interseluler lurus dan halus; dengan demikian, mereka menyajikan permukaan yang relatif sedikit untuk difusi kembali ke dalam sel-sel pad rektal. Menggunakan teknik micropuncture untuk menarik jumlah menit cairan dari berbagai daerah dari sel-sel pad rektal kecoa Amerika, P. americana, Wall dan Oschman (1970) menemukan bahwa cairan dari sinus subepitelial basal adalah hyposmotic ke cairan lumen rektal. Ini ditafsirkan bahwa muatan ionnya telah dikurangi oleh reabsorpsi K + ke dalam sel untuk didaur ulang.
17.6.2 Sekresi dan Reabsorpsi dalam Ileum
Ileum adalah bagian paling depan dari hindgut, terjadi hanya posterior ke asal tubulus Malphigi pada kebanyakan serangga. Studi paling rinci tentang fungsi ileal telah dilakukan di belalang gurun, S. gregaria. Dalam belalang, ileum adalah situs utama untuk reabsorpsi cairan isosmotik, untuk aktif Na + dan Cl-reabsorpsi, dan untuk sekresi aktif prolin sebagai sumber energi untuk mendukung proses metabolisme (Audsley et al., 1992a, 1992b; Phillips et al. ., 1988, 1994). Mekanisme pengendaraan untuk reabsorpsi ion dan air di ileum adalah pompa elektrogenik (Phillips et al., 1986, 1988). Sebuah neuropeptida, ion transport peptide (ITP), diisolasi dari korpus cardiacum gabungan S. gregaria merangsang Na +, Cl-, dan reabsorpsi air, dan mempromosikan reabsorpsi pasif K + oleh kopling listrik (Audsley et al., 1992a, 1992b; Phillips et al., 1994; Harrison, 1995; Meredith et al., 1996). ITP membutuhkan messenger kedua, yang mungkin cAMP berdasarkan pengamatan bahwa cAMP yang diaplikasikan secara eksogen merangsang ion dan reabsorpsi cairan. Beberapa ketidakpastian masih ada dalam cara ITP bertindak atas ileum. Meskipun ITP menghambat sekresi H + (yaitu, menghambat pembentukan NH4 +) di ileum, cAMP merangsang pembentukan NH4 + (Audsley et al., 1992b). Pengkodean gen ITP telah diteliti oleh Meredith et al. (1996), yang menyiapkan cDNA yang menyandikan peptida dengan 130 residu yang mungkin merupakan propeptida dari ITP, tetapi mekanisme yang digunakan oleh ITP aktif dari prohormone ini tidak dijelaskan. Hasil bersih dari pergerakan isi ekskretoris melalui ileum belalang gurun adalah volume cairan dikurangi seperti Na +, Cl-, K +, dan cairan yang diserap kembali (ion oleh mekanisme aktif dan cairan mengikuti gradien osmotik).The ileum memainkan peran utama dalam keseimbangan asam-basa (lihat Bagian 17.7.3) oleh sekresi H + ke lumen, pembentukan NH4 +, dan reabsorpsi HCO3 -. Metabolisme reabsorpsi asam amino non-esensial (alanin, asparagin, glutamin, serin, dan prolin) yang ada dalam urin melepaskan energi untuk sintesis ATP, sumber daya penting yang diperlukan untuk mendorong reabsorpsi aktif Na + dan Cl-. Sekitar 80% dari amonia yang diproduksi di sel epitel dari metabolisme asam amino ini diangkut (mekanisme tidak diklarifikasi) ke dalam lumen (Phillips et al., 1994) di mana ia diekskresikan sebagai NH4 +.
17.6.3 Reabsorpsi di Rektum
Rektum adalah tempat akhir dan utama untuk reabsorpsi ion, air, dan nutrisi, dan mampu menyerap kembali cairan terhadap gradien osmotik yang kuat, yang pada akhirnya menghasilkan banyak serangga, ekskresi hiposmotik yang sangat terkonsentrasi. Mekanisme penggerak untuk kation dan reabsorpsi air, seperti di ileum, adalah pompa elektrogenik di bawah pengaruh hormon neuropeptida, klorida transport stimulating hormone (CTSH), dari corpora cardiaca. Bertindak pada epitel rektum untuk mempromosikan aktif Cl-absorpsi (Phillips, 1964; Phillips et al., 1986, 1994; Harrison, 1995). Pompa menyediakan energi untuk reabsorpsi K +. Rute yang tepat diikuti oleh K + ketika melintasi sel-sel epitel rektum untuk memasuki kembali hemolymph atau tubulus Malphigi bervariasi dalam serangga yang berbeda tergantung pada anatomi rektum dan sel-sel yang terlibat dalam proses. Air dari lumen rektal dan zat terlarut terlarut mengikuti gradien osmotik yang diciptakan oleh penyerapan ion. Hasilnya adalah bahwa air diserap kembali ke dalam sel epitel terhadap gradien konsentrasi yang semakin kuat di lumen rektal. Ekskreta di rektum menjadi sangat pucat atau bahkan kering pada banyak serangga karena air diserap kembali. Sel epitel rektal aktif menyerap kembali asam amino dari lumen, dan memetabolisme mereka (terutama prolin) untuk menghasilkan ATP yang diperlukan untuk memberi energi pada pompa. Proline dimetabolisme di dalam mitokondria oleh jalur proline dehidrogenase (Chamberlin dan Phillips, 1982, 1983). Dengan demikian, sekresi ion aktif dan pompa elektrogenik memainkan peran utama dalam pembentukan urin primer di tubulus Malphigi dan kemudian mengambil kembali air dari hindgut. Beberapa hormon berbeda bertanggung jawab untuk mengatur fungsi-fungsi yang berbeda.
17.7 Peran Sistem Ekskresi dalam Mempertahankan Homeostasis
Perubahan dinamis dalam garam, air, asam-basa, dan jumlah nitrogen terjadi dari waktu ke waktu di semua organisme sebagai akibat dari makanan yang dicerna, kondisi lingkungan, dan metabolisme. Mekanisme pengaturan yang merespon dengan cepat terhadap perubahan ini diperlukan untuk menjaga integritas sel dan jaringan. Misalnya, herbivora mencerna jumlah yang relatif besar kalium dan sedikit natrium dengan pola makan nabati mereka, sementara pengumpan darah, seperti beberapa hemipterans dan nyamuk, menelan jumlah yang relatif besar natrium (kebanyakan natrium klorida) dan sedikit kalium dengan makanan mereka. Penelanan phloem tanaman atau getah xilem menghasilkan asupan air yang berlebihan, dan biasanya lebih banyak gula dan beberapa asam amino dari yang dibutuhkan. Nitrogen metabolit dari protein, asam amino, dan purin harus dibuang oleh semua sel. Pemeliharaan keteguhan lingkungan internal sel, jaringan, dan organisme adalah proses homeostasis, dan sistem ekskresi memainkan peran utama. Tubulus Malpighian memainkan peran utama dalam menghilangkan limbah metabolik dan racun yang diperoleh dengan atau dari makanan, biasanya dengan meningkatkan tingkat basal sekresi cairan, dan transportasi toksin, ke dalam lumen tubulus (Rheault et al., 2006; Ruiz -Sanchez dan O'Donnell, 2006, 2007a, 2007b; Ruiz-Sanchez dkk., 2007, dan referensi di dalamnya).
17.7.1 Homeostasis Elektrolit
Beyenbach (1995) meninjau mekanisme untuk mempertahankan homeostasis elektrolit, dengan penekanan khusus pada nyamuk yang memberi makan darah, A. aegypti, sebagai serangga model. Larva dan dewasa A. aegypti hidup di habitat yang berbeda, memiliki kebiasaan makan yang berbeda, dan mengontrol fungsi tubulus Malphigi oleh berbagai hormon. Nyamuk betina dewasa membutuhkan makan darah untuk mematangkan setiap butir telur, tetapi dengan darah, terdapat beban garam (NaCl) yang besar yang harus dikeluarkan. Sodium excretion adalah proses aktif dan terjadi di sel-sel tubulus Malphigi dari nyamuk dewasa dalam menanggapi rangsangan dari nyamuk natriuretik peptida (MNP) yang dilepaskan dari corpora cardiaca (Wheelock et al., 1988; Beyenbach, 1995, 2003). Pompa proton yang dipasangkan dengan mekanisme pertukaran H + –Na + akan mengeluarkan natrium ke dalam lumen tubulus. Pompa tampak berfungsi seperti yang dijelaskan sebelumnya untuk tubulus Malphigi secara umum, kecuali bahwa Na +, daripada K +, adalah ion utama yang ditukar dengan proton yang dipompa ke dalam lumen tubulus.Sebelum makan darah, urin terbentuk perlahan di tubulus yang terisolasi dari A. aegypti pada sekitar 0,4 nl / menit, dan tahanan transelular yang diukur, Rc, melintasi sel-sel tubulus tinggi, menjaga kation dan gerakan air rendah. Memberi makan pada makanan darah merangsang pelepasan MNP, dan cAMP dihasilkan sebagai utusan kedua di permukaan bagian dalam membran basolateral sel tubulus. cAMP bertindak selektif untuk membuka saluran Na + di membran basolateral. Ketika Na + memasuki sel tubulus dari hemolymph, Rc turun menjadi sekitar 40% dari nilai prefeeding (Wheelock et al., 1988). Pergerakan air ke dalam sel tubulus mengikuti gradien osmotik. Tingkat aliran urin setinggi 2,8 nl / menit dalam tubulus yang dirangsang hormon dipromosikan oleh membran apikal H + -pump ditambah dengan H + -Na + tukar. Fluks ion yang dihasilkan oleh MNP dan cAMP secara khusus merupakan peningkatan sekresi natrium. Gerakan kalium tidak terpengaruh. Tegangan dalam lumen tubulus Malphigi meningkat dari sekitar +52 mV pada nyamuk yang tidak digigit menjadi sekitar +70 mV pada nyamuk yang diberi makan (lumen positif terhadap hemolymph pada kedua kasus).
Beban klorida yang besar dari makanan darah juga harus dikeluarkan, dan klorida (Cl-) bergerak dari hemolimfa ke lumen tubula dalam jalur transpor pasif antara sel (disebut jalur paraseluler) (Pennabecker et al., 1993). Permeabilitas jalur paraseluler meningkat oleh leucokinin-VIII, sebuah neuropeptida (Wang et al., 1996), meskipun tidak diketahui apakah hormon ini atau yang serupa disekresikan oleh nyamuk.
Larva A. aegypti hidup di air tawar dan, dalam menanggapi peningkatan salinitas, mereka mengeluarkan 5-hydroxytryptamine (serotonin) ke dalam hemolymph, yang mengarah ke peningkatan pembentukan cAMP di tubulus Malphigi (Clark dan Bradley, 1993). Serotonin dan cAMP merangsang cairan dan ion (Na + dan K +) tingkat sekresi di tubulus larva terisolasi, tetapi urin tidak terkonsentrasi terhadap ion (Clark dan Bradley, 1996). Hemipteran R. prolixus yang memberi makan darah juga mengeluarkan Na + (dan K +) ke dalam lumen tubulus Malphigi. Perilaku hematophagous mungkin telah mendorong evolusi sekresi Na + oleh sel tubulus Malphigi, sehingga memungkinkan pengumpan darah untuk mengatur homeostasis ion setelah makan, besar asin.
Beyenbach (1995) meninjau tiga proses fisiologis potensial melalui mana A. aegypti dapat mengatur (kontrol) tingkat ion dan ekskresi cairan. Proses ini adalah (1) pompa proton yang memasok energi untuk Na + dan sekresi K + ke lumen tubulus, (2) resistensi Rc melintasi sel tubulus yang mengontrol saluran ion di membran basolateral, dan (3) resistansi pasif jalur transportasi untuk gerakan klorida. Peraturan pompa proton belum dibuktikan dalam tubulus Malpighian nyamuk (Beyenbach, 1995). Namun, saluran ion Rc dan basolateral diatur oleh peptida natriuretik dan cAMP pada nyamuk. Jalur transpor pasif antara sel tubulus mungkin merupakan fungsi sekresi ekstraseluler dari peptida tipe leucokinin pada nyamuk dewasa.
17.7.2 Homeostasis Air
Homeostasis air sangat penting bagi serangga karena memiliki rasio permukaan terhadap volume yang tinggi dan makanan mereka sering memiliki kadar air yang bervariasi. Meskipun banyak sistem dan perilaku fisiologis terkait dengan konservasi air, membersihkan tubuh kelebihan air terutama fungsi dari sistem ekskretoris. Ekskresi air dan retensi diatur oleh hormon. Hormon diuretik meningkatkan pembentukan cairan dan ekskresi cepat oleh tubulus Malphigi, sementara hormon antidiuretik yang sekarang dikenal bertindak atas hindgut (dengan satu pengecualian) dan mempromosikan reabsorpsi air. Pengecualian adalah hormon antidiuretik yang didemonstrasikan dari jangkrik rumah yang kekurangan air dan dikeringkan, Acheta domesticus, yang menghambat pembentukan cairan oleh tubulus Malphigi tanpa tindakan pada hindgut (Spring et al., 1988).
Diuresis berarti bahwa sekresi cairan ke dalam tubulus Malpighaina meningkat. Cairan mungkin tidak selalu dikeluarkan dari tubuh, seperti pada kumbang tertentu, yang dicatat di bawah ini. Saat ini lebih dari 20 hormon diuretik serangga diketahui. Semuanya neuropeptida. Mereka meningkatkan pembentukan cairan oleh tubulus Malpighian pada serangga di ordo Orthoptera, Lepidoptera, Diptera, Dictyoptera, dan Coleoptera (Wheeler and Coast, 1990). Serotonin (5- ydroxytryptamine, 5-HT), yang bukan neuropeptida, juga menstimulasi pembentukan urin (Barrett dan Orchard, 1990; Maddrell et al., 1991). Diuresis mengurangi beban penerbangan pada serangga yang memakan makanan darah besar pada satu waktu atau menelan getah tanaman dalam jumlah besar, jelas merupakan mekanisme fisiologis adaptif karena kelebihan air yang tidak diperlukan dan nutrisi penting dalam makanan cair perlu dikonsentrasikan dan dilestarikan. Diuresis pada kumbang yang hidup di lingkungan yang sangat kering tidak begitu jelas secara intuitif, tetapi mungkin memiliki fungsi penting seperti yang dijelaskan kemudian.
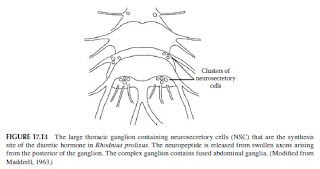
Rhodnius, serangga pertama yang diteliti secara mendetail sehubungan dengan hormon diuretik neuropeptida (Maddrell 1963, 1964a, 1964b, 1966), mengambil satu kali makan darah besar di setiap instar, dan dalam beberapa jam cepat mengeluarkan volume urin yang besar. Tindakan ini meninggalkan protein yang terkonsentrasi dari makanan darah di midgut, dan mengaliri tubuh kelebihan air dan Na +. Dalam beberapa menit setelah mulai makan, volume besar darah yang dicerna sangat mengecilkan perut dan mengaktifkan reseptor peregangan yang terletak di otot-otot yang tergosternal dekat tepi lateral segmen perut dua hingga tujuh. Cepat sirkulasi hemolymph diinduksi, disebabkan setidaknya sebagian oleh gerakan peristaltik kuat dari saluran pencernaan. Diuresis dimulai dalam 3 menit setelah makan, dimulai oleh sekresi 5-HT dan hormon diuretik neuropeptida yang disintesis di sel-sel neurosecretory besar di ganglion mesothoracic yang menyatu (Gambar 17.13). Neuropeptida dilepaskan dari serangkaian ujung aksonal membesar dari saraf perut yang berasal dari ganglion mesothoracic (Maddrell, 1966). Hormon diangkut ke tubulus Malphigi, jaringan target, dengan sirkulasi cepat hemolymph. Pada saat diuresis selesai, Rhodnius telah kehilangan 40% dari beratnya yang baru diberi makan. Konsentrasi osmotik dari hemolimfa yang pertama jatuh karena efek pengenceran dari menyerap begitu banyak air dari midgut, tetapi setelah diuresis konsentrasi osmotik hampir sama dengan sebelum menyusui. Tubulus Malpighian dan mungkin jaringan lain dengan cepat menghancurkan hormon diuretik, dan pelepasan berkelanjutan hormon diperlukan untuk mempertahankan ekskresi volume besar cairan. Triatoma infestans, vektor organisme penyakit Chagas, juga memakan makanan darah yang besar dan kemudian perlu menyingkirkan volume besar air. Serangga menghasilkan peptida allatotropin yang memiliki efek diuretik dan membantu ekskresi air berlebih (Santini dan Ronderos, 2007).
Diuresis juga di bawah kontrol hormonal yang sama di kapas stainer, Dysdercus fasciatus
(Hemiptera), yang mengambil getah tanaman. Sel-sel neurosecretory medial otak adalah sumber utama hormon dalam D. fasciatus, tetapi beberapa aktivitas hadir juga di corpora cardiaca dan di ganglion mesothoracic. Ekstrak dari median NSC mempercepat laju aliran urin dari nilai normal 3,1 mm3 × 10-3 sampai 9,87 mm3 × 10-3 per menit (Berridge, 1966).
Sebuah diuretik neuropeptida (MAS-DH) dengan 41 residu asam amino telah diisolasi dari M. sexta (Kataoka et al., 1989). Ini memiliki beberapa kesamaan urutan untuk corticotropin releasing factor (CRF) dan urotensin I, dua neuropeptida vertebrata dengan aktivitas hormonal, dan ke racun, sauvagine, dari kulit katak pohon Amerika Selatan. Sebuah reseptor untuk MAS-DH telah dicirikan dari tubulus Malphigi dari instar kelima cacing tanduk tembakau (Reagan et al., 1993). MAS-DH mengikat reseptor secara cepat dan reversibel (Lehmberg et al., 1991). Sebuah diuretik neuropeptida diisolasi dari L. migratoria (Mordue dan Morgan, 1985; Proux et al., 1987; Lehmberg et al., 1991, 1993) terdiri dari dua peptida asam 9-amino antiparalel yang disambung dengan dua ikatan disulfida, sebagai berikut:
Tubulus Malpighian dari kriket A. domesticus dirangsang untuk mensekresikan cairan oleh ekstrak jaringan (Spring dan Hazelton, 1987; Coast, 1988) dari corpora cardiaca (Gambar 17.14), corpora allata (Coast, 1989), dan beberapa bagian lain dari pusat sistem saraf (CNS) (Coast and Wheeler, 1990). Tubulus dalam kriket ini memiliki tiga segmen fisiologis dan morfologis yang berbeda (Kim dan Spring, 1992), dan ekstrak yang berbeda dapat bertindak pada segmen yang berbeda dengan mekanisme yang berbeda.
Kumbang, T. molitor, hidup dalam biji-bijian kering dan produk biji-bijian dan tidak memerlukan air selain yang sudah ada dalam makanan dan yang berasal dari metabolisme. Anehnya, itu menghasilkan hormon diuretik (Nicolson, 1991). Mengapa serangga yang hidup di lingkungan yang miskin air berevolusi menjadi hormon diuretik? Nicolson (1991) mengemukakan bahwa fungsinya adalah bertindak sebagai "izin hormon" untuk menyiram tubulus Malpighian dan hindgut. Cairan tubulus dapat dilewatkan ke hindgut untuk membantu memindahkan residu makanan yang sangat kering melalui usus, dan dapat membantu mendorong aliran arus balik di midgut. Cairan yang mencapai daerah rektum hampir semua diserap kembali oleh tubulus cryptonephridic dan kembali ke hemolymph.
Seekor kumbang tenebrionid lainnya, Onymacris plana, yang tinggal di padang pasir juga memiliki hormon diuretik, dan itu juga, mungkin memiliki fungsi pembilasan. Nicolson dan Hanrahan (1986) menemukan bahwa tubulus Malpighian yang terisolasi dari O. plana biasanya menghasilkan sekitar 3 nl / min / tubul, tetapi dengan stimulasi oleh hormon diuretik dari corpora cardiaca, tubul membentuk 40 sampai 60 nl, atau kadang-kadang sampai 100 nl / menit / tubulus. Mereka berspekulasi bahwa fungsi pembilasan mungkin bermanfaat bagi serangga dengan membantu menghilangkan allelochemical tanaman yang dimakan bersama makanan. Rektum menyerap kembali air dan melestarikannya untuk digunakan kembali.
Drosophila melanogaster mengatur sekresi cairan dengan setidaknya empat jenis peptida diuretik
hormon, termasuk DH44 dan DH31, neuropepide kinin, dan capa neuropeptida yang bekerja pada berbagai tipe sel di tubulus Malphigi (Pollock et al., 2004; Johnson et al., 2005, dan referensi di dalamnya). Keluarga capa peptida dan urutan asam amino mereka termasuk CAPA1 dan CAPA 2 dari Drosophila (GANMGLYAFPRVamide dan ASGLVAFPRVamide, masing-masing); AngCAPAQGL dan AngCAPA-GPT dari A. gambiae (QGLVPFPRVamide dan GPTVGLFAFPRVamide, masing-masing); dan CAP2b dari M. sexta (PyroELYAFPRVamide) (Pollock, 2004, dan referensi di dalamnya). DH44 dan DH31 meningkatkan tingkat sekresi dengan mengangkat tingkat cAMP dalam sel-sel utama tubulus (Johnson et al., 2005). Neuropeptida leukokinin mengatur transpor Cl dalam sel stellata dengan meningkatkan kalsium intraseluler, sedangkan capa peptida meningkatkan transpor cairan dengan meningkatkan regulasi pensinyalan pembawa pesan kalsium, nitrit oksida, dan cGMP pada sel-sel utama tubulus Malphigi. Mekanisme kerja neuropeptida ini tidak sama pada semua relatif sedikit serangga yang telah dipelajari hingga saat ini. Meskipun neuropeptida capa terjadi pada beberapa orde serangga dan sintase nitrit oksida, prasyarat untuk fungsi capa peptida, diketahui terjadi di tubulus Malphigi dari beberapa dipterans, lepidopteran, dan orthopteran, peran fisiologis peptida tidak seragam. Capa neuropeptida dari dipterans dan dari M. sexta tidak merangsang sekresi cairan atau mengaktifkan pensinyalan nitrat oksida / cGMP di S. gregaria atau Locusta migratoria (Pollock et al., 2004). Pada nyamuk, A. aegypti, leucokinin menstimulasi tingkat sekresi tubulus Malpighian, bukan di sel stellata, tetapi oleh jalur paraseluler melalui perpotongan septate antara sel-sel utama (Yu dan Beyenbach, 2004).
17.7.2.2 Hormon Antidiuretik
Umumnya serangga yang memakan makanan padat kering mungkin perlu menghemat air daripada membuangnya; dengan demikian, evolusi hormon antidiuretik mungkin diharapkan. Mills (1967) dan Goldbard dkk. (1970) menemukan bukti untuk kedua hormon antidiuretik dan diuretik di P. americana. Hormon antidiuretik mempromosikan konservasi air dan biasanya adalah hormon yang mendominasi. Hormon diuretik didemonstrasikan di P. americana hanya dengan menghilangkan kecoa laki-laki air selama 3 hari, setelah itu serangga haus minum cukup air sekaligus untuk merangsang pelepasan hormon diuretik, sehingga meningkatkan ekskresi air untuk sementara waktu. Percobaan ligasi menunjukkan hormon diuretik dilepaskan dari bagian posterior perut, dan ekstrak berbagai jaringan menunjukkan bahwa terminal ganglion perut adalah sumbernya. Reabsorpsi cairan di seluruh kompleks cryptonephric larva M. sexta telah dibuktikan dengan faktor antidiuretik diekstrak dari otak / corpora cardiaca (CC) / corpora allata (CA) kompleks ulat oleh Liao et al. (2000), yang menyarankan bahwa faktor tersebut melibatkan peningkatan cAMP dan aktivasi pompa Cl dalam sistem cryptonephric.
17.7.3 Homeostasis Asam Basa
Sistem ekskresi penting dalam menjaga keseimbangan asam-basa cairan tubuh dan jaringan (Harrison, 2001). Asidosis atau alkalosis dapat dialami oleh serangga tergantung pada berbagai makanan, kehadiran jenis senyawa kimia tertentu pada tanaman yang dimakan, jenis protein yang dimetabolisme (apakah protein menghasilkan proporsi asam asam amino basa, basa, atau netral yang tinggi), dan metabolik kondisi, seperti olahraga (misalnya, penerbangan) yang menghasilkan asam dalam jaringan (Harrison dan Kennedy, 1994). Belalang belalang barat, Taeniopoda menyatu, menunjukkan fleksibilitas dalam pergeseran antara ekskresi asam berlebih atau ekuivalen basa berlebihan (Harrison dan Kennedy, 1994) tergantung pada kebutuhan. Fleksibilitas dan kemampuan pengaturan ini pada serangga yang sangat polyphagous tampaknya adaptif, dan banyak serangga lain mungkin menunjukkan kemampuan yang sama (Harrison dan Kennedy, 1994).
Pengaturan asam-basa telah dipelajari secara menyeluruh di belalang gurun, S. gregaria, (lihat Phillips et al., 1994; Harrison dan Kennedy, 1994, dan referensi di dalamnya). Belalang yang secara eksperimental disuntik dengan HCl mengeluarkan sebagian besar asam setara dengan sekresi proton oleh epitelium hindgut. Tubulus Malpighian hanya berpartisipasi sedikit. Sekresi H + dan pembentukan ion amonium (NH4 +) di ileum adalah mekanisme utama untuk mengeluarkan ekuivalen asam ekses (Harrison, 1994; Harrison dan Kennedy, 1994; Phillips et al., 1994). The ileum adalah situs utama ammoniagenesis, pembentukan amonia dari prekursor, di belalang di mana sel-sel hindgut khusus memetabolisme asam amino dan glukosa untuk energi (Peach dan Phillips, 1991). Nitrogen berlebih dari gugus amino dimasukkan ke dalam pembentukan amonia. Metabolit ini hadir di lumen ileum, yang datang dengan urin yang terbentuk di tubulus Malphigi. Amonia dan urat hampir sama dalam konsentrasi dalam cairan dalam tubulus Malphigi, tetapi karena sekresi ileum dan rektal ion amonia / amonium, sekitar setengah dari total nitrogen
diekskresikan oleh belalang gurun adalah nitrogen amonia (Harrison dan Phillips, 1992). Beberapa amonia bereaksi dengan asam urat di hindgut untuk membentuk amonium urat, dan memberi makan natrium dan kalium, yang juga bereaksi dengan asam urat untuk membentuk natrium dan kalium urat. Dengan demikian, ekskresi total nitrogen amonia berfungsi beberapa fungsi dalam belalang (Harrison dan Phillips, 1992; Phillips et al., 1994; Harrison, 1995), termasuk:
1. Ammonium urate memungkinkan serangga untuk melestarikan Na +, ion yang tidak tinggi dalam makanan belalang.
2. Konversi amonia (NH3) ke amonium (NH4 +) dalam sel ileal setara dengan penghilangan proton (H +), dan ekskresi amonia lebih dari cukup untuk menjelaskan pemulihan pH hemolymph setelah beban HCl disuntikkan. ke dalam hemocoel.
3. Ekskresi amonia oleh belalang melestarikan air (karena pengendapan garam amonium urat tidak terlalu larut).
4. Meningkatkan ekskresi nitrogen hingga 25% lebih dari ekskresi hanya natrium atau kalium urat.
17.7.4 Homeostasis Nitrogen
Harrison (1995) telah membahas fakta bahwa nitrogen, meskipun dikenal sebagai nutrisi yang membatasi pertumbuhan untuk beberapa serangga, bagaimanapun diekskresikan dalam beberapa bentuk oleh serangga. Nitrogen berlebih yang harus dikeluarkan mungkin berasal dari konsumsi protein yang menyebabkan ketidakseimbangan asam amino; mereka menyimpan asam amino esensial dan dapat memetabolisme yang tidak penting sebagai sumber energi. Serangga juga menelan nitrogen dalam asam nukleat makanan mereka. Kelebihan protein nitrogen diekskresikan sebagai asam urat (purin) (Gambar 17.15), sebagai purin yang berhubungan dengan asam urat, seperti amonia atau garam amonium, dan dalam beberapa bentuk lain (biasanya kecil). Nitrogen dari asam nukleat juga diekskresikan sebagai asam urat (atau sebagai metabolit purin terkait atau metabolit asam urat). Biasanya, hanya jejak atau sejumlah kecil urea diekskresikan. Urutan lengkap enzim di jalur ureotelik untuk sintesis urea belum ditemukan pada serangga, tetapi arginase, enzim utama di jalur, aktif dalam tubuh lemak perut dan dada sepanjang siklus hidup nyamuk A. aegypti. Meskipun asam urat adalah produk ekskretoris primer, sejumlah kecil urea diekskresikan (Dungern dan Briegel, 2001). Bursell (1967) dan Cochran (1975) memberikan tinjauan menyeluruh dari literatur awal tentang produk ekskretoris nitrogen pada serangga.
Amonia adalah produk protein dan metabolisme asam amino. Amonia bebas tidak dapat disimpan dalam jaringan atau sel karena merupakan basa yang sangat kuat mempengaruhi pH dan, dalam bentuk bebasnya, sangat beracun bagi semua sel. Itu harus cepat dibuang atau diubah menjadi senyawa yang kurang beracun. Jika air tersedia untuk pengenceran, amonia dapat diekskresikan sebagai basa bebas atau sebagai garam amonium. Hewan yang mengeluarkan amonia sebagai produk limbah nitrogen utama mereka digambarkan sebagai ammoneoteleic.
Amonia adalah produk ekskretori utama untuk tahap larva dari beberapa Diptera yang hidup di lingkungan yang sangat basah. Larva Calliphora erythrocephala, ledakan biasa; Wohlfahrtia vigil, lalat sarcophagid (Brown, 1936); Phormia regina, sebuah blowfly; dan Lucilia cuprina, domba ked (Hitchcock dan Haub, 1941) mengeluarkan amonia ke lingkungan basah yang melarutkannya ke tingkat tidak beracun. Lucilia sericata, blowfly lainnya, mengeluarkan hingga 15 kali lipat lebih banyak amonia daripada asam urat (Brown, 1938). Meskipun asam urat disintesis, sebagian besar disimpan dalam jaringan (ekskresi penyimpanan). Allantoin, produk pemecahan asam urat, juga diekskresikan oleh larva L. sericata. Di dipteran ini, ekskresi amonia berhenti pada saat pupari, dan orang dewasa mengeluarkan asam urat, dan dalam beberapa kasus beberapa allantoin.
Staddon (1955, 1959) menemukan bahwa sebagian besar nitrogen yang diekskresikan oleh larva akuatik neuropteran, Sialis lutaria, dan odonate, Aeshna cyanea, adalah amonia. Meskipun beberapa serangga akuatik mengeluarkan sejumlah besar amonia, banyak yang mensintesis dan mengeluarkan asam urat (atau turunan metabolik lebih lanjut dari asam urat).
Beberapa serangga terestrial mengeluarkan sebagian besar nitrogen ekskretori mereka sebagai amonia atau garam amonium. Kecoa Amerika, P. americana, mengeluarkan amonia sebagai produk ekskretoris utama (Mullins dan Cochran, 1972), tetapi mekanisme ekskresi yang tepat belum dijelaskan. Amonia dan amonium nitrogen dapat mencapai 10% hingga 46% dari total nitrogen yang diekskresikan oleh belalang gurun, S. gregaria, menurut Harrison (1995), yang
autions bahwa studi sebelumnya pada distribusi nitrogen di ekskreta serangga terestrial mungkin telah kehilangan lebih banyak amonia dan amonium nitrogen yang labil oleh metode dan teknik yang digunakan. Nitrogen amonia cepat hilang dari pelet kotoran, terutama jika mereka dikeringkan sebelum analisis. Dalam beberapa kasus, amonium urat mungkin hilang karena tidak larut dengan baik kecuali bahan ekskretoris diekstraksi dengan volume besar pelarut berair (Harrison, 1995). Pelet fecal harus dikumpulkan dalam beberapa menit setelah dikeluarkan, disimpan dalam larutan asam, dan disimpan beku sampai analisis (Harrison, 1995).
Sebagian besar hewan, termasuk serangga, mensintesis amonia menjadi senyawa yang kurang beracun, seperti urea (mamalia) atau asam urat (burung, reptil, serangga, anjing Dalmatian). Enzim yang terlibat dalam metabolisme asam amino dan produksi amonia termasuk transaminase amino (atau transferase), asam glutamat dan dehidrogenase alanin, oksidase asam L dan D-amino, deaminase adenosin, dan monoamine oxidase. Semua enzim ini telah terdeteksi pada sejumlah serangga (Cochran, 1975).
Transaminase amino didistribusikan secara luas di jaringan serangga, dan memungkinkan gugus amino dari satu asam amino ditransfer ke asam keton, sehingga membentuk asam amino baru. Sebagai contoh,
Meskipun amonia tidak secara langsung dilepaskan dalam reaksi transaminase, reaksi menyediakan cara untuk mengubah asam amino non-esensial dan membuat asam amino tersedia untuk enzim yang mendeaminasi dengan pelepasan amonia, seperti dehidrogenase glutamat dan alanin dehidrogenase dalam reaksi berikut:
Amonia yang terbentuk dalam reaksi ini dengan cepat diekskresikan atau diubah menjadi senyawa yang kurang beracun. Asam α-ketoglutaric dan piruvat yang terbentuk dapat dimetabolisme melalui siklus Krebs sebagai sumber energi (Cochran, 1975).
Produksi amonia juga bisa berasal dari pergantian dan penggantian asam nukleat serangga sendiri serta dari metabolisme asam nukleat yang dicerna dengan makanan. Enzim adenosine deaminase, deaminase guanin, dan deaminase adenin, yang semuanya menghasilkan amonia dari metabolisme asam nukleat atau produk turunannya, telah dilaporkan dari berbagai serangga.
17.7.4.2 Sintesis dan Ekskresi Asam Urat
Asam urat disintesis pada serangga dari nitrogen protein serta dari nitrogen asam nukleat. Bagian utama disintesis dari protein nitrogen hanya karena serangga mengkonsumsi relatif lebih banyak protein nitrogen (atau asam amino nitrogen) dalam makanan mereka daripada asam nukleat nitrogen (Cochran, 1975). Pada burung (dan mungkin dalam serangga) sintesis satu mol asam urat dari NH3 membutuhkan pengeluaran 8 mol ATP (Cochran, 1975). 8 ATP / asam urat yang terbentuk mengabaikan biaya lain yang mungkin timbul, seperti transportasi melintasi membran sel dan pemeliharaan mesin enzimatik. Jadi, ekskresi asam urat sebagai produk utama metabolisme protein sangat mahal. Keuntungannya adalah bahwa rids tubuh empat atom nitrogen, yang membentuk 33,3% dari berat molekul asam urat (MW asam urat = 168,11, 4 N = 56), dan sangat larut dalam air. Ini sering mencapai konsentrasi yang mendorong pengendapan dari larutan di tubulus Malpighian dan hindgut dan, sebagai endapan, itu tidak berkontribusi terhadap nilai osmotik di sel yang melapisi tubulus atau hindgut.
Tubuh lemak adalah situs utama untuk sintesis asam urat. Barrett and Friend (1970) menemukan bahwa glisin memberikan kontribusi karbon karboksil ke posisi 4 dan α-karbon ke posisi 5 selama sintesis asam urat dalam R. prolixus. Formasi berkontribusi karbon ke posisi 2 dan 8. Karbon karboksil berlabel dari glisin dikonversi dengan cepat di Rhodnius ke 14CO2, dan banyak dari 14CO2 yang terbentuk memunculkan berlabel karbon 6 dalam asam urat. Karbon α-glisin juga dapat berkontribusi pada sintesis formate, sehingga pada akhirnya sebagian atau bahkan banyak karbon-8 asam urat juga mungkin berasal dari glisin. Meskipun asal atom nitrogen dalam asam urat dari Rhodnius tidak ditentukan, tampaknya cukup yakin bahwa atom nitrogen berasal dari NH3 yang dihasilkan dari metabolisme protein, asam amino, dan asam nukleat (Barrett and Friend, 1970).
asam urat (Gambar 17.16). Enzim yang mengkatalisis konversi dua langkah adalah xanthine dehydrogenase (Irzykiewicz, 1955). Mitranya dalam vertebrata (burung dan reptil) adalah xanthine oxidase, oksidase sejati karena oksigen molekuler dapat menerima proton yang dikeluarkan dari hypoxanthine dan xanthine. Enzim serangga tidak bekerja tanpa NAD + atau FAD + (atau akseptor sintetis, seperti biru metilen) sebagai akseptor proton, sehingga merupakan dehidrogenase sejati. Transfer elektron dari kofaktor yang berkurang melalui sistem transpor elektron dapat menghasilkan enam (NADH) atau empat (FADH2) ATP / molekul asam urat yang terbentuk. Evolusi xanthine dehydrogenase pada serangga, bukan xanthine oxidase, mungkin telah terjadi sebagai cara potensial untuk memulihkan beberapa biaya sintesis urat (Cochran, 1975).
Asam urat dan senyawa uricotelic yang terkait adalah produk ekskretoris adaptasi yang mengagumkan untuk hewan yang hidup dengan tekanan air dan kebutuhan untuk menghemat air. Senyawa ini memiliki kelarutan terbatas, dan ketika mereka mengkristal dari larutan, mereka mengurangi kerja osmotik yang diperlukan untuk menyerap kembali air dari rektum. Asam urat adalah yang paling larut dari senyawa (6 mg / 100 ml air) diikuti oleh allantoin (60 mg / 100 ml), hypoxanthine (70 mg / 100 ml), dan xanthine (260 mg / 100 ml) Bursell, 1967 ). Asam urat dapat mengkristal sebagai asam urat bebas dan / atau sebagai garam. Data yang disajikan oleh Harrison (1995) menunjukkan bahwa amonium urat jauh lebih sedikit larut daripada natrium atau kalium urat, dan memiliki keuntungan bahwa NH4 + rids tubuh nitrogen tambahan dan setara asam.
Penyimpanan ekskresi asam urat, atau pengendapan di berbagai bagian tubuh, sering terjadi pada kecoak dan beberapa serangga lainnya. Kristal asam urat dapat terjadi di hemolymph, dan di jaringan lain, terutama di tubuh lemak. Cochran (1973) menemukan kadar tinggi asam urat kristalin dalam tubuh lemak dari 14 spesies kecoak. Laki-laki kecoa deposito asam urat di kelenjar aksesori yang terkait dengan saluran reproduksi mereka, dan deposito urates dari kelenjar di luar paket sperma, atau spermatophore, yang mereka hasilkan dan masukkan ke betina saat kawin. Mullins dan Keil (1980) menemukan bahwa asam urat berlabel kecoa Blattella germanica jantan dapat ditemukan pada kecoa Jerman betina, dan di oothecae mereka setelah kawin. Mereka menyarankan bahwa urat mewakili sumber nitrogen untuk investasi perempuan dan ayah oleh laki-laki dalam keturunannya.
Perilaku investasi ayah juga ditunjukkan oleh kecoa tropis, Xestoblatta hamata, di mana betina memakan urat yang disimpan di ruang kelamin oleh laki-laki selama kawin. Wanita mentransfer urat ke oosit terminal dan ootheca (Schal dan Bell, 1982). Di bawah kondisi lapangan dan laboratorium, laki-laki X. hamata memilih makanan berprotein tinggi, yang diketahui menghasilkan produksi urat dalam kecoak (Haydak, 1953), dan mereka memberi makan secara oportunistik pada zat yang mengandung asam urat, seperti kotoran burung.
Tubulus Malphigi dari kecoa Amerika, P. americana, tidak membersihkan asam urat dari
hemolimfa, dan kecoak tidak mengeluarkan asam urat dengan kotoran kotoran (kecuali dalam jumlah kecil di bawah kondisi padat, yang mungkin karena mereka telah mengkanibal kecoa lain dan asam urat tertelan yang hanya melewati usus) (Mullins dan Cockran, 1972 ). Sebagian besar nitrogen yang dikeluarkan oleh kecoa Amerika adalah nitrogen amonia (Mullins dan Cockran, 1972).
Razet (1966) menemukan bahwa banyak serangga mengeluarkan persentase kecil hingga besar dari nitrogen ekskretori mereka sebagai allantoin, produk pemecahan asam urat yang dikatalisis oleh enzim uricase (lihat Gambar 17.16). Terjadinya uricase tersebar luas di serangga dan di jaringan mereka, tetapi tidak ada keuntungan khusus yang diketahui untuk konversi asam urat ke allantoin atau untuk itu sebagai produk ekskretoris. Beberapa serangga mengeluarkan beberapa asam allantoic, produk oksidasi allantoin, tetapi enzim allantoicase tidak meluas pada serangga dan, jika ada, allantoic acid adalah produk ekskretoris yang sangat kecil.
Hewan yang mengeluarkan sebagian besar atau semua nitrogen ekskretoris mereka sebagai asam urat digambarkan sebagai uricotelic. Kadang-kadang telah dipertanyakan apakah serangga benar-benar sesuai dengan definisi uricotelism (dibahas dalam Cochran, 1975) karena beberapa serangga tidak mengeluarkan sebagian besar nitrogen mereka sebagai asam urat. Bursell (1970) mengusulkan memperluas definisi uricotelism untuk memasukkan ekskresi allantoin dan asam allantoic, karena keduanya berasal dari metabolisme lebih lanjut dari asam urat. Cochran (1975) setuju dengan definisi yang lebih luas, dan memperluasnya lebih lanjut untuk memasukkan ekskresi asam urat prekursor hypoxanthine, xanthine, dan guanin diekskresikan oleh beberapa serangga (Morita, 1958; Mitchell et al., 1959; Nation dan Patton, 1961; Nation, 1963; Nation and Thomas, 1965; Mitlin dan Vickers, 1964). Dengan demikian, Bursell (1970) dan Cochran (1975) menyimpulkan bahwa, sebagai suatu kelompok, serangga harus tetap dianggap urikotelik dalam ekskresi meskipun beberapa mengeluarkan berbagai senyawa nitrogen dan sedikit mengeluarkan relatif sedikit atau tidak ada asam urat.
17.8 Sistem Cryptonephridial
Banyak keluarga Coleoptera, Lepidoptera, dan beberapa larva gergaji (Hymenoptera) memiliki pengaturan tubulus Malphigi di mana ujung distal tubulus diselimuti dalam membran dan dipegang dekat dengan permukaan rektum (Gambar 17.17). Pengaturan ini dikenal sebagai sistem tubulus cryptosolenic atau cryptonephridic. Tampaknya pengaturan yang memungkinkan konservasi air yang sangat efisien. Serangga yang hidup di habitat paling kering dan makan makanan yang sangat kering memiliki perkembangan dan jaringan tubulus cryptonephridial yang paling luas.
Tubulus Cryptonephridic tidak menembus lumen rektum, tetapi terletak di permukaan luar rektum, terbungkus dalam ruang perineum yang dibatasi oleh membran perinefrik (Gambar 17.18). Membran perinefik tersusun atas sel-sel tipis dan memanjang yang menyegel tubulus dari hemocoel dan hemolymph pada titik awal kontak dengan usus (Saini, 1964). Tubulus tidak berhenti segera setelah menghubungi rektum, tetapi biasanya dilemparkan ke banyak loop dan konvolusi, dengan segmen yang berjalan secara radial di sekitar rektum serta perulangan anterior dan posterior sepanjang panjang rektum (Saini, 1964). Membran perinefik mengikuti berbagai konvolusi dan putaran, selalu menutup tubulus seperti selimut. Beberapa lapisan tubulus mungkin terletak pada rektum pada serangga yang hidup di lingkungan yang paling kering (Saini, 1964). Sebuah ruang perirectal kecil terjadi antara lapisan sel epitel rektum dan lapisan tubulus terdalam dalam ruang perinefrik.
Makanan serangga, khususnya Coleoptera, bervariasi dalam kadar air. Beberapa Coleoptera adalah phytophagous, makan makanan dengan kandungan air yang relatif tinggi, sementara yang lain memakan produk biji-bijian yang disimpan kering atau bahan makanan kering serupa. Dalam Coleoptera fitoplastik, daerah rektum posterior yang mengandung pelet fecal sesaat sebelum dikeluarkan lebih kecil dan memiliki lebih sedikit konvolusi tubulus daripada di Coleoptera yang memakan makanan kering (Saini, 1964). Coleoptera yang hidup di lingkungan yang sangat kering, seperti T. molitor dan kumbang pengganggu biji-bijian dan kumbang penggerek lainnya, memiliki sistem cryptonephridial besar yang memungkinkan mereka untuk mengekstraksi lebih banyak air dari pelet fecal.
Pada titik yang sering di sebagian besar Coleoptera, tubulus cryptonephridic di lapisan terluar
melakukan kontak dengan membran perinefrik luar melalui sel tunggal yang sangat dimodifikasi dari dinding tubul yang disebut sel leptophragma. Titik-titik kontak ini ketika tubulus dipisahkan dari hemolymph hanya oleh membran sel tipis dari sel leptophragma dan membran perinefrik yang sangat tipis (pada titik tertentu) disebut leptophragmata. Hanya dua keluarga kumbang, Ptinidae dan Anobiidae, tidak memiliki leptophragmata, tetapi tidak ada Lepidoptera yang dipelajari oleh Saini (1964) memilikinya.
Dalam T. molitor dan beberapa kumbang lainnya, membran perinefrik yang tipis diperluas menjadi suatu bourcurure, sebuah kata Perancis yang berarti lepuhan (Gambar 17.19) di atas setiap sel leptophragma. Fungsi pasti dari boursouflure tidak pasti. Ramsay (1964) dan Grimstone dkk. (1968) mengusulkan bahwa itu mungkin situs sekresi aktif ion dari hemolymph ke tubulus perinefrik, sehingga menciptakan nilai-nilai osmotik tinggi di tubulus cryptonephridic untuk membantu gerakan pasif air ke bawah gradien osmotik dari lumen rektal ke lumen tubulus. Ada beberapa bukti (Maddrell, 1971) bahwa senyawa berat molekul tinggi (mungkin protein) disekresikan ke dalam ruang perirectal T. molitor, dan yang pertama menyerap air dari rektum, dengan air diteruskan ke tubulus.
Tubulus Cryptonephridic dari Lepidoptera tidak memiliki leptophragmata atau sel leptophragma.
Dengan demikian, terlepas dari fungsi sel leptophragma di Coleoptera, mereka tidak penting untuk sistem di Lepidoptera. Seperti dalam Coleoptera, tingkat layering loop cryptonephridial pada dubur berkorelasi dengan habitat dan makanan yang dimakan oleh larva (Saini, 1964). Pada larva yang memakan tanaman hijau, lapisan tubulus paling dalam hanya memanjang sekitar sepertiga panjang bagian anterior rektum, dan hanya ada satu lapisan tubulus yang tidak dikemas sangat berdekatan pada setengah posterior rektum anterior. . Pada larva yang hidup dalam kondisi yang sangat kering dan makan makanan kering (misalnya, Galleriidae, Phycitidae, Tineidae), tubulus yang berbelit-belit itu saling berdekatan di lapisan dalam dan luar dan memperpanjang seluruh panjang rektum anterior. Tidak ada sistem cryptonephridic tubulus di Lepidoptera akuatik, Paraponyx (= Nymphula) stratiotata dan Cataclysta lemnata (Pyraustidae). Pada serangga tersebut ujung distal tubulus Malphigi hanya terletak pada rektum yang berhubungan dengan beberapa jaringan lemak tubuh dan trakea. Meskipun kompleks crytptonephric telah dipelajari dengan baik secara anatomis, studi fisiologis sangat jarang.
Sumber :
Nation JL. 2008. Insect Physiology and Biochemistry Second Edition. New York: CRC Press.




















Posting Komentar untuk "Sistem Ekskresi Serangga"